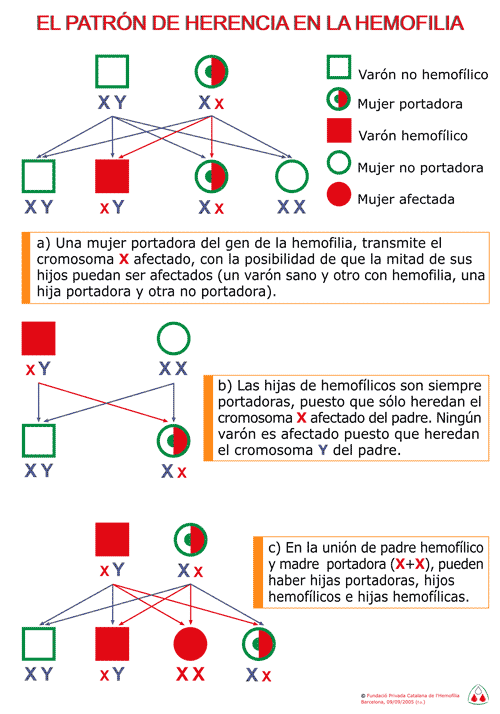
En esta figura se ilustra la descendencia familiar de
un enfermo hemofílico y la de una mujer portadora.
- En el primer caso todos los hijos varones son normales
y todas las hijas son portadores.
- En el segundo caso la mitad de las hijas son portadoras
y la mitad de los hijos presentan la enfermedad .
1.2. Tipos de hemofilia:
Se han descrito los déficits congénitos
de diferentes factores de la coagulación (factor
II, factor V, factor VII, factor X, fibrinógeno),
pero identificamos con el nombre de hemofilia A la deficiencia
de factor VIII, y con el de hemofilia B (llamada también
enfermedad de Christmas) la de factor IX. La hemofilia
A es entre 4 y 5 veces más frecuente que la B.
1.3. Gravedad de la hemofilia:
Se han descrito tres niveles de gravedad de la hemofilia
(grave, moderada y leve) en relación a la actividad
de factor presente en el plasma. Este hecho es muy importante
por dos motivos:
Generalmente, pero no siempre, el nivel de actividad
de factor presente en el plasma del enfermo determina
la frecuencia y gravedad de las manifestaciones hemorrágicas,
y como consecuencia define las necesidades del tratamiento.
De este modo, cuanto menor sea el nivel de actividad
de factor en el plasma, mayores serán las hemorragias
y también aumentará el uso de factor para
tratarlas.
El nivel de actividad de factor, y por tanto la gravedad
de la hemofilia, se mantiene constante en una familia
determinada. De esta manera el niño hemofílico
en una familia con historia de hemofilia moderada también
tendrá una forma moderada de esta enfermedad.
Cuando el nivel de factor es inferior al 1%, hablamos
de hemofilia grave. En estos casos las hemorragias espontáneas
son muy frecuentes y graves.
Frecuentemente los enfermos con hemofilia grave presentan
alteraciones importantes en las articulaciones como
consecuencia de las repetidas hemorragias articulares.
Las pequeñas cantidades de factor, entre el
1 y el 5%, presentes en los enfermos con hemofilia moderada
son suficientes para proporcionar una cierta protección,
de manera que las hemorragias espontáneas son
menos graves y menos frecuentes.
Los enfermos con hemofilia leve tienen niveles de
factor entre el 5 y el 25%. Estos no presentan hemorragias
espontáneas y frecuentemente se les diagnostica
cuando son adultos.
1.4. La coagulación
normal:
La hemostasia es el conjunto de mecanismos y reacciones
que tienen como finalidad mantener la sangre en el interior
de los vasos sanguíneos, impidiendo su salida
a los tejidos que la envuelven. Este fenómeno
tiene 4 fases: fase vascular, fase plaquetaria, fase
plasmática y fibrinólisis.
Fase vascular:
Consiste en un reflejo nervioso que tiene como objetivo
la liberación de unas sustancias que provocan
la contracción del vaso lesionado, disminuyendo
el flujo de sangre y en consecuencia la hemorragia.
Fase plaquetaria
Se desarrolla en dos etapas: la adhesión de
las plaquetas al subendotelio vascular y la agregación
de las plaquetas entre sí. En esta fase es muy
importante la participación del factor von Willebrand,
que establece puntos de unión entre las plaquetas
y los vasos lesionados.
El factor von Willebrand es una proteína del
plasma a la que está fijado el factor VIII. Su
deficiencia o ausencia da lugar a otra enfermedad hemorrágica
conocida como enfermedad de von Willebrand.
Otras proteínas como la fibronectina y el fibrinógeno
así como el calcio son también necesarios
para el buen funcionamiento de este mecanismo.
Fase plasmática:
Es el conjunto de reacciones enzimáticas que
tienen la finalidad de convertir el fibrinógeno,
que es una proteína soluble, en fibrina insoluble.
La fibrina tiene una estructura fibrilar y es la base
del coágulo.
El conjunto de enzimas que intervienen en esta fase
son los llamados factores de coagulación, que
circulan en la sangre de forma inactiva y se convierten
en formas activas por la acción de otro factor
previamente activado.
En la figura se observan las diversas recciones que
tienen lugar en esta fase, que se desencadenan por dos
vías:
- Intrínseca, cuando la sangre entra en contacto
con el colágeno subendotelial y un conjunto de
proteínas que forman lo que se denomina sistema
de contacto.
La cefalina es la prueba de laboratorio que analiza
esta vía.
- Extrínseca, que se inicia cuando la sangre
entra en contacto con el factor tisular, que es una
proteína presente en los tejidos y que se libera
cuando hay una lesión vascular. La prueba de
coagulación que explora la vía extrínseca
es el tiempo de Quick o tasa de protrombina.
(falta img)
Fibrinólisis:
Al mismo tiempo que se desencadenan las reacciones descritas,
se ponen en funcionamiento los mecanismos que tienden
a disolver el coágulo con la finalidad de que el
vaso lesionado vuelva a ser permeable y la sangre circule
nuevamente. Este mecanismo se denomina fibrinólisis
y se basa fundamentalmente en la actividad de una enzima,
la plasmina, que degrada la fibrina.
Del perfecto equilibrio entre estos mecanismos depende
que la sangre se mantenga líquida en el interior
de los vasos sanguíneos, que únicamente
se forme un coágulo cuando se produce una lesión
vascular y que posteriormente los vasos vuelvan a ser
permeables.
2. Manifestaciones
clínicas de la hemofilia: 
Las manifestaciones hemorrágicas del enfermo hemofílico
están en relación con la gravedad de la
hemofilia, presentándose de forma espontánea
en los hemofílicos severos y sólo después
de traumatismos o intervenciones quirúrgicas en
los enfermos moderados.
Les hemorragias pueden aparecer a cualquier edad o
en cualquier parte del organismo. Su gravedad dependerá
del volumen de la hemorragia, de su localización
y de la capacidad de dejar secuelas o lesiones irreversibles.
2.1. Las
hemorragias en el bebé
Hasta un 2% de los enfermos pueden presentar hemorragia
intracraneal durante el parto. En alguna ocasión,
esta puede ser la forma de presentación de la
enfermedad, especialmente cuando no existen antecedentes.
Cuando se hace un diagnóstico prenatal se debe
evitar la vacuoextracción (extracción
mediante ventosa) del feto, dado que los hematomas cefálicos
pueden producir anemia y tardan en reabsorberse.
A veces pueden asociarse a hemorragia cerebral. Durante
los primeros meses, las manifestaciones clínicas
son poco importantes.
Si es necesario practicar análisis, las extracciones
tienen que hacerse con el máximo cuidado para
evitar la aparición de hematomas importantes.
Los enfermos deben recibir todas las vacunas propias
de la edad y, además, las de la hepatitis A y
B. Con la dentición pueden aparecer sangrados
bucales, pero la complicación oral más
frecuente es el sangrado por la rotura del frenillo
de la lengua durante la fase de desarrollo oral.
Al empezar a caminar, los hematomas de las piernas
y de los glúteos son los más frecuentes
y empiezan a aparecer las hemartrosis.
2.2. Localizaciones hemorrágicas
más frecuentes
Hemorragias mucosas:
Pese a que generalmente revisten poca gravedad, generalmente
requieren tratamiento. Las más frecuentes son
las epistaxis (hemorragia nasal), las gingivorragias
(hemorragia por las encías), las secundarias
a heridas por mordedura de la lengua o a la caída
de la primera dentición (dientes de leche).
Especial gravedad pueden tener las secundarias a heridas
por espinas de pescado en la faringe ya que pueden producir
hematoma faríngeo con obstrucción de las
vías aéreas, y en consecuencia con la
imposibilidad de respirar normalmente.
Hematomas musculares:
Se producen espontáneamente, por traumatismos
directos o por esguinces en ejercicios violentos. Se
ponen de manifiesto por dolor, aumento del volumen y
del calor local y impotencia funcional.
Las lesiones musculares provocadas por la presencia
de sangre crean una tendencia a producir nuevas hemorragias
del músculo dañado.
Dado que hay músculos encapsulados, la tensión
provocada por la sangre vertida puede producir la destrucción
del músculo, la compresión del sistema
vascular (arterias y venas) y de los nervios vecinos
con consecuencias funcionales importantes.
Esto se conoce con el nombre de síndrome compartimental,
que se produce fundamentalmente en el antebrazo y en
la pierna.
Cabe destacar el hematoma del psoa que se manifiesta
por dolor en la ingle y flexión del muslo, a
menudo tiene tendencia a reaparecer.
Hemorragia cerebral:
Puede producirse de manera espontánea, si bien
generalmente aparece después de traumatismos.
Se manifiesta por la presencia de dolor de cabeza, vómitos
y pérdida del nivel de conciencia.
En ocasiones, con deficiencias motoras y trastornos
de la coordinación. Requieren tratamiento substitutivo
inmediato con el factor deficiente y en ocasiones puede
ser necesario también el tratamiento quirúrgico.
Hemorragia articular:
Son las más frecuentes en los enfermos hemofílicos.
Se caracterizan por dolor, aumento del tamaño
de la articulación, calor y pérdida de
movimiento.
La articulación afectada queda inmovilizada
en la posición que permita un mayor volúmen
de la cavidad articular.
La presencia de sangre en el interior de la articulación
pone en marcha una serie de mecanismos que afectan a
la membrana sinovial, provocando su hipertrofia y la
tendencia a presentar nuevas hemorragias.
Los depósitos de hierro y la inflamación
crónica de la sinovial (sinovitis crónica
hipertrófica) afectará también
al cartílago y al hueso. A la larga se producirá
una destrucción de la articulación con
pérdida de movilidad e incluso su fijación
en posiciones viciosas.
Para evitar estas complicaciones, es muy importante
el tratamiento correcto de las hemorragias articulares.
Hemorragia urinaria:
Las hematurias espontáneas no son infrecuentes
en el enfermo hemofílico. Generalmente, no es necesario
un tratamiento específico, el reposo y una abundante
hidratación son suficientes.
En ocasiones, cuando aparecen de forma secundaria a
la presencia de litiasis (cálculo o piedra),
es necesario un tratamiento urológico específico.
Hemorragia digestiva:
Son producidas por lesiones digestivas diversas típicamente
hemorrágicas:
- hernia de hiato,
- ulcus,
- varices esofágicas,
- tumores y enfermedades ulcerativas como la enfermedad
de Crohn y la colitis ulcerosa.
Se ponen de manifiesto por la presencia de hematemesis
(vómitos de sangre), melenas (sangre oscura en
la deposición) y rectorragias (sangre roja en
la deposición).
Además del tratamiento substitutivo, con factor,
y si es necesario también con sangre, es indispensable
diagnosticar el foco hemorrágico, generalmente
mediante endoscopia.
Hemoptisis:
La aparición de hemoptisis no es más frecuente
en los enfermos hemofílicos pero pueden ser más
graves. Son secundarias a diferentes patologías
del aparato respiratorio (tuberculosis, tumores, fístulas
artiovenosas y otras alteraciones bronquiales.
En estos casos será necesario diagnosticar
la lesión responsable de la hemorragia mediante
broncoscopia o exámenes radiográficos.
En todos los casos es necesario iniciar precozmente
el tratamiento con el factor deficiente para normalizar
la coagulación. Se debe acudir al hospital de
forma urgente en las situaciones siguientes:
- Hemorragias que por su localización puedan
comportar importantes pérdidas sanguíneas
que requieran la transfusión de sangre.
En este apartado se incluyen las hemorragias digestivas,
las hemorragias en la cavidad abdominal y los hematomas
en grandes músculos.
- Hemorragias localizadas en zonas vitales: cavidad
craneal y vías aéreas.
2.3. Diagnóstico
de la hemofilia:
Se puede pensar o sospechar en el diagnóstico de
hemofilia ante enfermos con hemorragias espontáneas
o secundarias a traumatismos, especialmente si aparecen
en las primeras etapas de la vida o en el momento del
nacimiento.
La evaluación detallada de los antecedentes
hemorrágicos del enfermo y de su familia será
una ayuda importante para orientar el correcto diagnóstico
de hemofilia.
A continuación es indispensable la participación
del laboratorio. En los enfermos con coagulopatías
congénitas se evidencian alteraciones en las
pruebas que miden globalmente la coagulación.
Concretamente en el caso de la hemofilia A y B se
encuentra alargada la cefalina. La confirmación
del tipo de hemofilia se obtiene cuando se detecta una
ausencia o una disminución significativa del
factor VIII (hemofilia A) o del factor IX (hemofilia
B).
2.4. Diagnóstico
molecular de la hemofilia:
La hemofilia se manifiesta cuando en los genes de los
factores VIII o IX se producen mutaciones, es decir,
alteraciones en el DNA que dan lugar a la ausencia o
pérdida de funcionalidad de la proteína.
Ya que los genes constituyen el material que se transmite
de padres a hijos, estas mutaciones, y por lo tanto
la enfermedad, también son transmitidas a la
descendencia.
El diagnóstico molecular de una enfermedad
genética como la hemofilia consiste en la identificación
del defecto o mutación en el gen o bien en la
identificación del cromosoma que es portador
del gen defectuoso.
Esto tiene una repercusión directa ya que posibilita
la realización de un adecuado consejo genético
y diagnóstico prenatal a los miembros de la familia
que así lo soliciten.
La identificación del cromosoma portador del
gen mutado se realiza mediante los estudios de ligamiento:
se utilizan marcadores polimórficos cercanos
a los genes responsables que permiten relacionar un
cromosoma determinado de la familia estudiada con la
manifestación de la enfermedad.
Estas técnicas, sin embargo, tienen una serie
de limitaciones que condicionan su uso, como pueden
ser los casos esporádicos, las familias no informativas
para los polimorfismos o la ausencia de al menos un
familiar hemofílico vivo.
Gracias a los recientes avances en la tecnología
de secuenciación del DNA, y para evitar las limitaciones
intrínsecas del análisis de ligamiento,
se han diseñado protocolos simplificados para
poder detectar la presencia de mutaciones en los genes
de los factores VIII y IX.
En el caso de la hemofilia A existe una mutación
que es mucho más frecuente que el resto, es la
llamada inversión del intrón 22. Esta inversión
es responsable del 50% de las hemofilias A severas.
Por lo tanto, un primer paso en el diagnóstico
molecular de la hemofilia A severa es ver si esta inversión
es la responsable de la enfermedad en la familia.
Las técnicas empleadas para detectar esta mutación
no requieren la secuenciación y por lo tanto
pueden ser realizadas de manera más o menos rápida.
El resto de mutaciones descritas causantes de hemofilia
A y B incluyen mutaciones puntuales, delecciones, inserciones
y están localizadas a lo largo de los genes.
Esto obliga a determinar toda la secuencia o composición
del gen del factor de coagulación correspondiente
en el enfermo y compararla con una secuencia normal
para identificar las mutaciones presentes.
Las mutaciones encontradas, como ya se ha mencionado,
permiten el diagnóstico prenatal y consejo genético
adecuados, pero además, estas mutaciones son
enviadas a bases de datos internacionales conjuntamente
con datos clínicos, de manera que constituyen
una fuente de estudio que permitirá en el futuro
introducir mejoras en las terapias de sustitución
con factores recombinantes así como en los ensayos
de terapia génica.
3. Tratamiento
de la hemofilia: 
3.1. Concentrados de factores de coagulación
Los aspectos que permiten diferenciar los diferentes
concentrados de factores de coagulación son:
la fuente biológica de obtención (productos
derivados del plasma y productos recombinantes), la
pureza y los métodos de inactivación viral
incluidos en el proceso de producción.
Los concentrados plasmáticos se obtienen después
de fraccionar, purificar y someter el plasma a técnicas
específicas de inactivación viral.
La calidad y seguridad del producto final son consecuencia
de la suma de diversas etapas que incluyen la selección
de donantes, el análisis de las donaciones individuales
y del plasma para fraccionamiento y las etapas específicas
de inactivación viral.
Los concentrados de FVIII derivados del plasma se
clasifican según su grado de pureza en productos
de pureza intermedia (PI), alta pureza (AP) y ultrapuros
(UP).
La mayoría de estos productos contienen una
cantidad relevante de albúmina, que se utiliza
como estabilizante.
Algunos de los preparados contienen factor von Willebrand
funcional, por este motivo son utilizados también
en el tratamiento de la enfermedad de Von Willebrand.
Los productos de tecnología recombinante se
obtienen después de diversas etapas:
1. introducción del gen que codifica el factor
VIII o IX en células de mamíferos,
2. multiplicación de estas para obtener un banco
de células con capacidad de formar factor VIII
o IX,
3. incubación de las células en un medio
de cultivo apropiado para que produzcan el factor deseado,
4. purificación del factor producido por estas
células,
5. tratamiento para la inactivación viral,
6. estabilización del factor y liofilización.
Los productos recombinantes tienen un elevado grado
de pureza.
Dependiendo del proceso de producción utilizado,
pueden contener pequeñas cantidades de proteína
y ADN de la célula huésped, trazas de
inmunoglobulinas murinas como consecuencia de la purificación
del factor con anticuerpos monoclonales murinos y de
albúmina humana o bovina utilizadas en el medio
de cultivo.
Actualmente se tiende a la utilización de medios
de cultivo sin proteínas de origen humano o animal
y a la substitución de la albúmina humana
por sacarosa como estabilizante del producto final.
En las
tablas I, II y III: 
Se recogen los diferentes factores de coagulación
actualmente disponibles en nuestro país.
Tabla I. Concentrados de factor VIII
PRODUCTO Laboratorio PROCEDENCIA PURIFICA-CIÓN
INACTIVA-CIÓN VIRAL ESTABILI-ZACIÓN INDICACIÓN
HAEMATE P®Aventis Plasma humano Precipitación
Pasteuriza-ción Albúminahumana Hemofilia
A Enfermedad devon Willebrand.
BERIATE P®Aventis Plasma humano Cromatografíaint.
Iónico Pasteuriza-ción Sacarosa Hemofilia
A.
FANHDI®Grifols Plasma humano Cromatografíaafinidad
heparina S/D +80 ºC, 72h Albúminahumana
Hemofilia A.
HEMOFIL®Baxter Plasma humano CromatografíaInmunoafinidad
S/D Albúminahumana Hemofilia A.
MONOCLATE P®Aventis Plasma humano CromatografíaInmunoafinidad
Pasteuriza-ción Albúminahumana Hemofilia
A.
RECOMBINATE®Baxter Recombinante(CHO) Cromatografías
int. iónico yinmunoafinidad - Albúminahumana
Hemofilia A.
REFACTO®Wyeth Recombinante(CHO) Cromatografíasint.
iónico yinmunoafinidad S/D Sacarosa Hemofilia
A.
KOGENATE BAYER® BayerHELIXATE NEXGEN® Aventis
Recombinante(BHK) Cromatografías Int. Iónico
yInmunoafinidad S/D Sacarosa Hemofilia A
BHK= células renales cría hámster;
CHO= células ovario hámster xino;
S/D=solvente/detergente
1 Actividad específica excluyendo albúmina
y FvW
2Molécula de FVIII con delección del dominio
B
Tabla II. Concentrados de factor IX y complejo de protrombina
PRODUCTO Laboratorio, PROCEDENCIA, PURIFICACIÓN,
INACTIVACIÓNVIRAL, ESTABILIZACIÓN, INDICACIÓN
FACTOR IX-X PBEHRINGÒ Aventis Plasma humano
Adsorciónsobre resina Pasteurización Estabilizantesno
proteicos Déficit FIX, FX.
IMMUNINESTIM PLUSÒ (FIX)Baxter Plasma humano
Cromatografíaint. iónico yint. Hidrofóbica
Vapora presión +Detergente Estabilitzantesno
proteicos Hemofilia B.
MONONINEÒ (FIX)Aventis Plasma humano Cromatografía
Inmunoafinidad Tiocianato sódico+ Ultrafiltración
Estabilitzantesno proteicos Hemofilia B.
BENEFIXÒ (FIX)Baxter Recombinante(CHO) Cromatografíaint.
Iónico Nanofiltración Estabilitzantesno
proteicos Hemofilia B
Tabla III. Otros concentrados de factores de coagulación
PRODUCTO Laboratorio PROCE-DENCIA PURIFICA-CIÓN
INACTIVA-CIÓN VIRAL ESTABILIZA-CIÓN INDICACIÓN
FEIBA IMMUNO TIM 4Ò(complejo protrombina activado)Baxter
PlasmaHumano AdsorciónSobre resina Vapora presión
Estabilizantesno proteicos Hemofilia A y Bcon inhibidor.
NOVOSEVENÒNovo Nordisk Recombinante(BHK) Cromatato-grafíaint.
Iónico yinmunoafi-nidad Detergente Estabilitzantesno
proteicos Hemofilia A y Bcon inhibidor
3.2.
Administración del factor: 
En primer lugar, es necesario seguir escrupulosamente
las instrucciones del fabricante del factor que están
descritas en el prospecto del producto. Como normas
generales se tiene que tener en cuenta:
- Reservar el producto liofilizado (el frasco con polvo
blanco) en la nevera a 4º C, no en el congelador.
Los otros elementos (agua destilada, aguja y jeringa)
no es necesario que estén en estas condiciones.
- Preparar el factor en una superficie limpia y que
después, si se precisa, se pueda limpiar con
lejía.
- Desinfectar la superficie de la piel con una solución
desinfectante.
- Tirar las agujas y jeringas en un contenedor rígido.
3.3. Modalidades de tratamiento y dosis
El tratamiento substitutivo se puede hacer de forma
profiláctica o sólo cuando se produce
hemorragia.
En este último caso, es necesario aplicarlo
lo más rápidamente posible. Si se administra
antes de las primeras 4 horas, la respuesta es más
efectiva y rápida.
Por esta razón se aconseja el tratamiento domiciliario.
La dosis y duración del tratamiento dependerá
de la gravedad de la hemorragia.
En la tabla se exponen las guías generales
para tratar las hemorragias más frecuentes. Estos
datos deben ser considerados como aproximados, ya que
en cada caso es necesario valorar aspectos individuales
de cada enfermo.
HEMORRAGIA NIVEL ÓPTIMO
FACTOR % DURACIÓN TRATAMIENTO días:
Articulares |
30 - 50 % |
1 - 3 dias |
Hematoma muscular |
30 - 50 " |
1 - 3 " |
Digestiva |
30 - 50 " |
2 - 3 " |
Faringe |
40 - 60 " |
3 - 4 " |
Retroperitoneal |
30 - 50 " |
3 - 4 " |
Intracraneal |
60 - 80 " |
7 - 10 " |
Urinaria |
30 - 50 " |
1 - 2 " |
Menor |
20 - 30 " |
1 - 2 " |
Los concentrados de factor se pueden administrar en
forma de bol (dosis única repetida según
las necesidades) o en infusión continua.
Esta última modalidad se utiliza cuando se tienen
que mantener niveles plasmáticos altos de factor
durante un período alargado, tal y como pasa en
las hemorragias agudas graves o durante las intervenciones
quirúrgicas.
El tratamiento profiláctico se aplica a enfermos
con deficiencia grave (factor VIII o IX inferior al
1%) para evitar la aparición de artropatía
secundaria a las hemartrosis repetidas.
Se empieza en los primeros años de vida y consiste
en la administración de tres dosis semanales
en hemofilia A y dos dosis en hemofilia B para mantener
niveles mínimos superiores al 1-2% de forma permanente.
Las dosis oscilan entre 30 y 50 UI por kg de peso.
Muchas veces, empezar este tratamiento tan pronto
es difícil porque no se dispone de accesos venosos
adecuados y es necesario implantarlos, solución
no exenta de complicaciones, especialmente las infecciones.
3.4. Otros tratamientos
A veces, un análogo de la vasopresina, el acetato
de desmopresina (DDAVP o Minurinâ), administrado
por vía nasal o intravenosa, puede ser útil
para la profilaxis o para el tratamiento de las hemorragias
leves en enfermos con hemofilia A moderada o leve.
Este fármaco provoca un aumento inmediato pero
transitorio de los niveles de factor VIII y no tiene
efectos secundarios notables, exceptuando rubor facial
y conjuntival transitorios.
Los antifibrinolíticos (ácido tranexámico
o Amchafibrinâ y ácido épsilo-amino-caproico
o Caproaminâ) son una buena opción como
tratamiento coadyuvante a las hemorragias de mucosas,
exceptuando las hematurias. Se administran por vía
oral o intravenosa y son muy bien tolerados.
Existen también hemostáticos por vía
tópica como la trombina liofilizada, colágeno
y otros, que no han demostrado demasiada eficacia.
En cambio, otras substancias preparadas comercialmente
(Tisucol®) son capaces de producir un coágulo
de fibrina y son útiles al aplicarlas como hemostáticos
sobre las heridas.
3.5. Complicaciones del
tratamiento con factores de coagulación
Actualmente el nivel de seguridad en relación
a la transmisión de virus patógenos conocidos
es muy elevada como consecuencia de todas las medidas
que se han establecido en los últimos años,
y que se han descrito en el apartado anterior.
En este sentido es necesario destacar que el objetivo
principal del desarrollo de nuevos productos es la minimización
del riesgo de transmisión de enfermedades.
Aunque en los últimos años se ha producido
una cierta alarma en relación a la posible transmisión
de la variante de la enfermedad de Creutzfeldt-Jakob
por los factores, en base a los conocimientos actuales
se puede afirmar que este riesgo es muy bajo o inexistente.
La formación de inhibidores, continúa
siendo hoy en día una de las complicaciones más
graves del tratamiento de la hemofilia.
Aunque en un principio se creyó que la utilización
de productos recombinantes se asociaba a una mayor incidencia
de inhibidores, los estudios recientes indican que su
aparición es parecida en los dos tipos de factor,
plasmático y recombinante.
Otras complicaciones del tratamiento con factores
de coagulación, como pueden ser las alteraciones
de la función inmune o las complicaciones tromboembólicas,
han sido muy minimizadas con la utilización de
productos de elevada pureza.
3.6. Los
inhibidores 
Los inhibidores del factor VIII y IX son anticuerpos
que aparecen en algunos enfermos hemofílicos
después de recibir concentrados del factor correspondiente.
Estos anticuerpos son capaces de neutralizar el factor
administrado condicionando que el tratamiento sea ineficaz.
En la actualidad es la complicación más
grave de los enfermos hemofílicos, ya que dificulta
mucho la prevención y el tratamiento de las hemorragias.
Aparecen en aproximadamente el 25% de los enfermos
con hemofilia A y en el 5% de los afectados de hemofilia
B.
Generalmente, se producen después de las primeras
administraciones de factor, apareciendo en enfermos
muy jóvenes.
Actualmente se sabe que el tipo de mutación
del paciente constituye un factor de riesgo para la
formación de inhibidores, y se ha detectado una
mayor incidencia de inhibidores asociada a determinadas
mutaciones del gen del FVIII.
Cabe sospechar la presencia de un inhibidor cuando
la respuesta clínica al tratamiento no es la
esperada.
Aunque la eficacia del tratamiento sea correcta, es
recomendable hacer la determinación periódica
de la presencia de inhibidores mediante análisis
de laboratorio, basados en la capacidad que tiene el
plasma del enfermo de neutralizar, en el laboratorio,
el factor VIII o el factor IX.
La actividad de los inhibidores se mide en Unidades
Bethesda (UB).
Una UB/ml es la actividad de un inhibidor capaz de
neutralizar 0.5 unidades de factor VIII o factor IX.
Se consideran inhibidores de baja respuesta a los
que no superan las 10 UB, y de alta respuesta a los
que tienen una actividad superior a las 10 UB.
3.7. Alternativas terapéuticas en los enfermos
hemofílicos con inhibidor. Anulación del
inhibidor:
Cuando el título del inhibidor es bajo, se pueden
utilizar dosis más altas de factor VIII o factor
IX para el tratamiento de las hemorragias.
El factor VIII porcino tiene las mismas calidades
hemostáticas que el factor VIII humano y en algunos
enfermos no es reconocido por el inhibidor.
Puede producir efectos secundarios, como reacciones
alérgicas y trombocitopenia, aunque han mejorado
con los nuevos métodos de purificación;
actualmente se utiliza poco.
Los concentrados de complejo de protrombina activada
han demostrado su eficacia terapéutica, aunque
tampoco están exentos de efectos secundarios
al utilizarlos en dosis elevadas (por ejemplo, trombosis).
Se utilizan en dosis de 50-100 UI por kg cada 8-12 horas.
Desde hace unos años, el factor VIIa recombinante
es otra alternativa terapéutica muy eficaz. Su
inconveniente es su corta vida media en el plasma, lo
que requiere administraciones cada 2-3 horas para el
control de las hemorragias.
Tal y como pasa en los enfermos sin inhibidor, es
necesario utilizar medidas complementarias como reposo,
inmovilización, aplicación de frío
local, etc.
Dado que las alternativas terapéuticas en los
enfermos con inhibidor son más limitadas, una
vez diagnosticada la presencia del inhibidor, es necesario
plantearse su anulación; es el llamado tratamiento
de inmunotolerancia.
Consiste en administrar inyecciones repetidas (generalmente
diarias) del factor de coagulación que falta
(VIII o IX) con la finalidad de que el sistema inmunitario
del propio enfermo se vuelva tolerante al factor deficitario,
efecto que se consigue en un 75-85% de los enfermos
tratados.
4. Otras
recomendaciones: 
4.1. Higiene oral
Es evidente que en los enfermos con coagulopatías
las intervenciones odontológicas, incluidas las
más senzillas o rutinarias como las obturaciones
o empastes dentales, representan un problema a tener
muy en cuenta dado el riesgo hemorrágico.
Por este motivo, los enfermos hemofílicos,
a menudo, se encuentran con dificultades para ser atendidos
en las consultas convencionales.
Como consecuencia de estos hechos, la prevención
de las principales patologías orales, caries
y enfermedad periodontal (gingivitis y periodontitis)
en el enfermo hemofílico adquiere una transcendencia
muy superior a la de las demás personas.
Podemos asegurar que si en la población normal,
sin patologías previas, esta prevención
es importante, en el enfermo hemofílico, especialmente
si coexisten infecciones víricas, pasa a ser
un objetivo fundamental.
Las patologías que hemos mencionado anteriormente
son altamente susceptibles a las medidas preventivas.
Las principales medidas preventivas de la cavidad oral
están basadas en los hábitos de higiene
oral diarios.
Es importante destacar que no se ha demostrado hasta
el momento que la hemofilia predisponga a sufrir con
más severidad caries o gingivitis (inflamación
de las encías).
Normalmente, en el enfermo hemofílico así
como en los otros enfermos odontológicos, el
sangrado de las encías se produce más
frecuentemente por la inflamación de los tejidos
gingivales, consecuencia de la falta de un cepillado
eficaz, que por la alteración de la coagulación
coexistente.
Como norma general, los niños y los adultos
han de hacer un mínimo de dos cepillados dentales
diarios, por la mañana y por la noche, de tres
minutos de duración en cada caso, utilizando
una pasta dental con flúor.
El uso de soluciones específicas a base de flúor
u otras sustancias que refuercen la salud de las encías
serán indicadas únicamente por el profesional
a cada enfermo en particular según la edad y
la patología presente.
Es necesario aconsejar también una visita periódica
al odontólogo. Semestral o anual, dependiendo
de la edad del enfermo y del riesgo detectado de alguna
de las principales enfermedades orales.
En aquellos casos en que sea necesario hacer un tratamiento
en la cavidad oral, es indispensable que exista una
buena comunicación entre el hematólogo
y el odontólogo para establecer un protocolo
de actuación que tenga en cuenta el riesgo de
la intervención y la posible necesidad de administrar
factor.
Desde un punto de vista odontológico, se consideran
de riesgo las intervenciones siguientes:
- la limpieza dental que requiere profundizar por debajo
de las encías,
- la anestesia troncular, utilizada con frecuencia en
el tratamiento de los molares inferiores,
- las extracciones dentales (exodoncia).
Las obturaciones o empastes dentales son intervenciones
de bajo riesgo, siempre que no requieran un grado de
anestesia profunda.
Aunque la colocación de prótesis dentales
y aparatos de ortodoncia no son manipulaciones de riesgo,
es necesario hacer el control adecuado de los aparatos
con la finalidad de prevenir la aparición de
úlceras y lesiones que conlleven hematomas u
otras hemorragias en la cavidad oral.
4.2. Ejercicio
físico: 
La práctica de ejercicio físico y deporte
es importante en el enfermo con hemofilia como una forma
amena de mantener el tono muscular que protege las articulaciones.
Además es también una excelente forma
de relación social con otros niños o adultos.
En primer lugar es fundamental escoger una actividad
satisfactoria para cada enfermo y que su práctica
no suponga un riesgo superior al posible beneficio.
Como norma general, no debemos someter las articulaciones
con lesiones previas, a movilizaciones que fuerzen el
arco articular o a resistencias que provoquen una sobrecarga.
La potenciación muscular, básica para
la prevención de la patología articular,
se puede obtener, sin complicaciones, mediante la práctica
de ejercicios isométricos, que contraen el músculo
sin movilizar la articulación adyacente.
Naturalmente es posible ir más allá
y en este sentido la Federación Mundial de Hemofilia
aconseja los siguientes deportes:
- Natación
- Tenis mesa (ping-pong)
- Senderismo
- Pesca
- Baile
- Golf
- Bolos
- Badminton
- Ciclismo
- Paddle
Por norma general, se consideran peligrosos todos los
deportes que conllevan una cierta violencia (boxeo, motociclismo)
o contacto físico (balonmano, baloncesto).
Aunque el fútbol es el deporte que más
se practica, especialmente en las escuelas, no es recomendable
dado el riesgo de contacto directo con la pelota y el
continuo contacto, a menudo violento, entre los jugadores.
Antes de iniciar una actividad deportiva, es necesario
hacer un período de calentamiento para prevenir
lesiones musculares, y al finalizar se completa la sesión
con suaves ejercicios de estiramiento.
Es importante utilizar un calzado adecuado que controle
bien el pie y el impacto del talón.
En caso de molestias articulares o musculares, por
pequeñas que sean, es necesario interrumpir inmediatamente
la actividad. Si existen lesiones articulares o musculares,
es indispensable esperar a su completa resolución
antes de iniciar nuevamente la actividad deportiva.
Los enfermos que están en tratamiento profiláctico
pueden aprovechar los períodos con buenos niveles
de factor para desarrollar estas actividades deportivas,
con menos riesgo de presentar complicaciones hemorrágicas.
En la práctica de un deporte por parte de los
enfermos con hemofilia, es necesario encontrar un equilibrio
entre el beneficio esperado, como consecuencia de la
actividad física y la potenciación muscular,
y las posibles complicaciones.
Será necesario seleccionar una actividad bastante
atractiva para el enfermo pero que se adapte a la posible
patología articular existente.
Dado que la mayoría de los enfermos en edad
de crecimiento siguen pautas de tratamiento profiláctico,
es recomendable coordinar el tratamiento y la práctica
de deporte, de manera que la máxima actividad
coincida con los niveles más altos de factor.
5. La
terapia génica en hemofilia: 
La terapia génica es una manera nueva de tratar
las enfermedades basada en la introducción de
material genético dentro de las células
para corregir un problema biológico.
Los genes son fragmentos de ADN que contienen la información
para la formación de las proteínas necesarias
para el funcionamiento normal de todo el organismo.
La terapia génica pretende corregir la enfermedad
proporcionando a las células información
para que sean ellas mismas las que fabriquen el producto
activo (la proteína), en lugar de administrarlo
directamente como se hace con los fármacos convencionales.
En el caso de la hemofilia se administraría
al enfermo el gen del factor de coagulación que
le falta en lugar de darle el factor.
Aunque en el futuro será posible reparar los
errores que existen en un gen y dan lugar a la enfermedad,
los objetivos actuales son más modestos.
Actualmente, la terapia génica trata de corregir
el defecto en la función de un gen anómalo
introduciendo una copia normal de este en las células.
La investigación actual está centrada
en desarrollar genes más eficaces, y vehículos
o vectores que se encarguen de hacer que el material
genético entre dentro de las células.
Los vectores más eficaces para que la entrada
de material genético sea en cantidad suficiente
son los de tipo viral.
En ellos se eliminan los genes fundamentales para
su multiplicación y se sustituyen por el gen
terapéutico para aprovechar su capacidad de entrar
dentro de las células.
Hasta el momento se han realitzado cuatro ensayos
clínicos en humanos, en los que se han utilizado
diferentes estrategias. De los resultados obtenidos
en ellos se ha podido deducir que las estrategias utilizadas
y las dosis suministradas son seguras.
En el primer ensayo, que tuvo lugar hace 10 años
en la China, se trataron a dos hermanos con hemofilia
B grave con células propias previamente extraídas
y a las que se había introducido el gen del factor
IX.
Así se consiguió una persistencia de
la actividad de más de un año. Hasta noviembre
de 1998 no se realizó el siguiente ensayo, en
esta ocasión fue con la hemofilia A.
La empresa Transkaryotic Therapy, Inc trató
a los enfermos con células propias en las que
se había introducido el gen del factor VIII,
esta vez sin la ayuda de vectores virales.
Los resultados que se han publicado este año
muestran que con esta estrategia se pueden conseguir
niveles de entre el 1-2% respecto a los normales.
A mediados de 1999 se iniciaron dos ensayos más,
en estos casos aplicando los vectores virales directamente
en los pacientes.
La empresa Chiron trabajó en la administración
intravenosa de un tipo de virus con el gen del factor
FVIII, mientras que la empresa Avigen en su ensayo utilizó
la inyección intramuscular de otro virus, más
pequeño y con el gen del factor FIX. En los dos
casos se ha observado una disminución de la frecuencia
de sangrado.
En el año 2000 se han iniciado dos ensayos
más de los que no se dispone aún de resultados.
6. 10 puntos
clave en la hemofilia: 
01. Hay actividades que no te convienen, disfruta de todo
aquello que puedes hacer.
02. Aprende a administrarte el factor siguiendo las medidas
higiénicas necesarias, esto te dará autonomía.
03. El tratamiento precoz de las hemorragias puede evitar
complicaciones más serias; no te quedes nunca sin
factor en casa.
04. Ante la presencia de hemorragias que puedan ser vitales
(cerebrales y faringe) ponte factor y acude ;rápidamente
al Hospital; consulta con el médico ante cualquier
situación de duda.
05. No tomes aspirina ni otros antiagregantes plaquetares,
consulta con tu médico qué fármacos
puedes tomar.
06. Practica de manera habitual el ejercicio físico
que te pueda ser más útil.
07. Sé muy cuidadoso con la higiene oral y acude
al dentista una vez al año.
08. Es muy importante realizar estudios genéticos
para conocer la existencia de otras portadoras en la familia.
09. El consejo genético es muy aconsejable ante
el planteamiento de cualquier nuevo embarazo en la familia.
10. En caso de desplazamiento averigua cuáles son
los posibles hospitales de referencia.

7. Ciudad
Sanitaria Valle d’Hebron (Sanitary city Valle
de Hebron)
Unidad de Hemofilia (Unit of Hemophilia)
(Hospital Traumatologia)
Paseo Valle de Hebron, 119-129
08035 - Barcelona - Catalonia,
tf. 0034/ 93 274 62 07
(hemophilia Emergency 24 h.)
tf.: 34-93 274 60 00
fax: 34-93 274 90 27
Organization type: Treatment Centre
Contacto:
Dr. Rafael Parra Lopez , (Coordinator
- Coordinador)
Dra. Carmen Altisent
c-electronic: rparra@vhebron.net
(Coordinador - Coordinator)
Web: www.vhebron.es
_________________________________________
Hospital Clinico
y Provincial de Barcelona
Servei d’Hemoterapia i Hemostasia
Unidad de Hemofilia - Unit of Haemophilia
Servicio de Hemoterapia y Hemostasia
Villarroel 170
08036 - Barcelona - Catalonia,
tf.: 34 93 227 54 39 (Emergency)
34 93 227 54 39
34 93 227 54 00
Organization type: Treatment Centre
Contacto: Dr. J. Monteagudo
c-electronic: monteaugu@clinic.ub.es
Web: www.hospitalclinic.org
_______________________________________
Hospital de la Santa Cruz
i Sant Pablo
Servei d’Hematologia - Unit of Haemophilia
Av. Sant Antoni Mª Claret, 167
08025 - Barcelona - Catalonia,
tf.: 0034/ 93 347 31 33
Organization type: Treatment Centre
Contacto: Dr. J. Fontcuberta
c-electronic: mgari@santpau.es
Web: www.santpau.es
__________________________________________
Hospital de Sant Joan
de Deu (San Juan de Dios)
Ctra. d’Esplugues, s/n
08034 -Barcelona - Catalonia,
tf.: 0034/ 93 280 40 00
Organization type: Treatment Centre
Contacto: Dra. Mª Teresa Toll
c-electronic: info@hsjdbcn.org
web: www.hsjdbcn.org/index.jsp
__________________________________________
Residencia Sanitaria
Josep Trueta (Sanitary residence)
Avda de França, s/n
17005 -Girona - Catalonia,
tf.: 0034/ 972 20 27 00
Treatment Centre of Hemopilia
Contacto: Dra. Bustin
c-electronic: hospital@htrueta.scs.es
www6.gencat.net/ics/trueta/scripts/default.asp
________________________________________
Residencia Sanitaria
Joan XXIII (Sanitary residence)
Mallofré i Guasch, s/n
43007 - Tarragona - Catalonia,
tf.: 34/977 21 77 50
Treatment Centre of Hemopilia
Contacto: Dra. Ugarriza
Admissions: 34/977 29 58 04
Urgències: 34/977 29 58 81
c-electronico: %20hospital@hj23.com
web: www.hj23.com
___________________________________________
Residencia Sanitaria
Arnau de Vilanova (Sanitary residence
C/. Huesca, s/n
25001 - Lleida - Catalonia,
tf.: 0034/ 973 24 81 00
Treatment Centre of Hemopilia
Contacto: Dra. Araguas
c-electronico: biblioteca@arnau.scs.es
Web: www.arnau.scs.es
Resposable del Àrea d'informació mèdica:
Dr. Miquel Rutllant Bañeres, nomenat pel Patronat de la FPCH, número de col·legiat 4679, especialitat hematologia i hemoteràpia.
|